AdhexPharma SAS
CDMO für transdermale Pflaster und oromukosale Filme







Über die Anlage
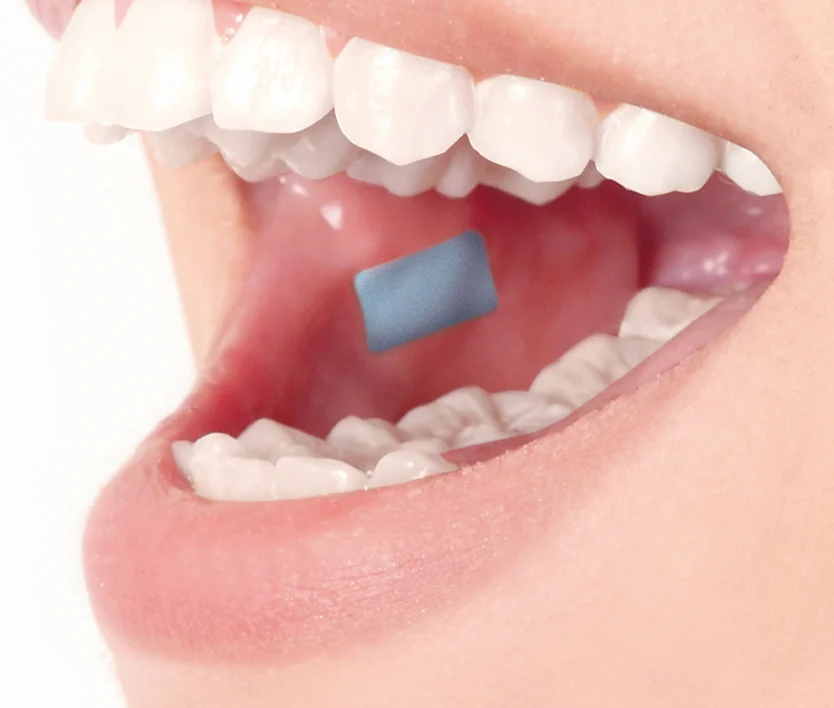
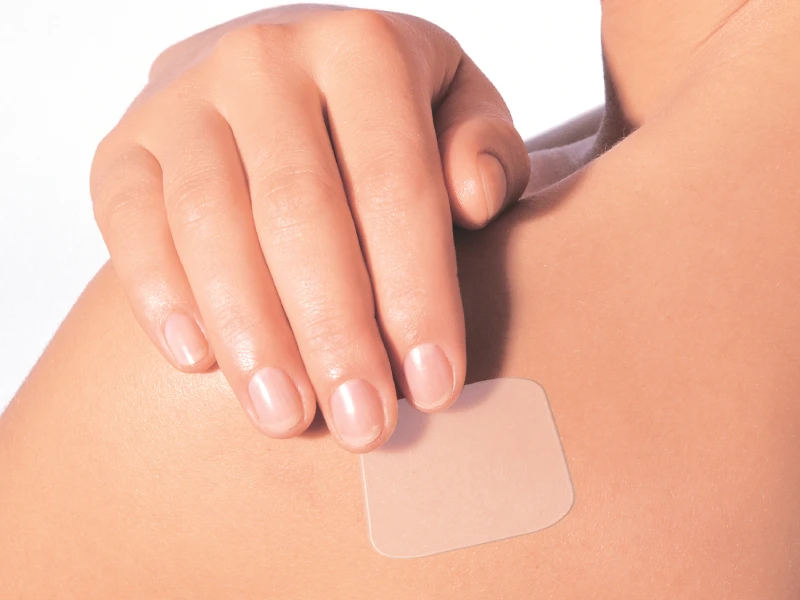
AdhexPharma ist ein Full-Service-CDMO mit Standorten in Frankreich und Deutschland, spezialisiert auf die Entwicklung und Herstellung von transdermalen und topischen Pflastern (TDS) sowie orodispersiblen und bukkalen Filmen (ODF).
Mit über 40 Jahren Erfahrung in Arzneimittelabgabetechnologien bieten wir End-to-End-Lösungen – von der Formulierungs- und Analytikentwicklung bis hin zur klinischen und kommerziellen Herstellung, Verpackung, Lizenzierung und regulatorischen Unterstützung.
Unsere Anlage produziert jährlich über 100 Millionen Einheiten und bedient eine vielfältige Kundenbasis – von aufstrebenden Biotech-Unternehmen bis hin zu etablierten Pharmafirmen in Europa, Nordamerika und ausgewählten internationalen Märkten.
Der Standort umfasst Reinraumbereiche, Pilot- und Industrieanlagen sowie dedizierte F&E- und QC-Labore, die sowohl die frühe als auch die großskalige Produktion unterstützen.
Unsere Infrastruktur erstreckt sich über mehr als 15.000 m² in vier qualifizierten Gebäuden in Frankreich und Deutschland, und wir sind zur Handhabung von kontrollierten Substanzen autorisiert.
Derzeit unterstützen wir eine Pipeline von über 15 Entwicklungsprojekten und bieten Out-Licensing-Möglichkeiten für proprietäre Arzneimittelabgabeplattformen.
Durch die Kombination tiefgreifender Expertise in TDS- und ODF-Technologien mit einem flexiblen, partnerschaftsorientierten Ansatz bietet AdhexPharma hochwertige, integrierte CDMO-Dienstleistungen, um Ihre Arzneimittelentwicklung von der Idee bis zur Markteinführung zu beschleunigen.
Compliance
- ISO
- EMA (EU-GMP)
- FDA (cGMP)
- 13485 (Medizinische Geräte)
Tätigkeit
- Orale Feststoffe / OSD, Topisch, mukosal und transdermal, Orodispergible / Sublinguale Filme, Buccale (muco)adhäsive Filme, Oralstreifen, Aufnäher, FDF/DROGENPRODUKTE Herstellung
Eigenschaften
- Verwendet: Untersuchung, Kommerziell (Phase IV), Präklinisch, Phase I, Phase II, Phase III, Menschlich, Veterinär
- Toxizität (OEB-Einstufung): 1 / gering gefährdet (PDE > 5.000 µg/Tag), 2 (PDE = 1.000 - 5.000 µg/Tag), 3 (PDE = 100 - 1.000 µg/Tag)
- Kontrollierte Substanz: Hohes Missbrauchspotenzial und medizinische Verwendung, Geringeres Missbrauchspotenzial, Geringes Missbrauchspotenzial, Geringstes Missbrauchspotenzial
- BSL: N/A
- Therapeutische Bereiche: (D) Dermatologische Produkte, (H) Systemische Hormonpräparate außer Sexualhormonen und Insulinen, (N) Nervensystem
- Märkte: FDA (USA), EMA (EU), PMDA (Japan), Gesundheit Kanada (Kanada), MHRA (UK)
Chargengröße / Reaktor
- Klein, Mittel, Groß
Dienstleistungen
- Entwicklungsdienste, Fertigungsdienstleistungen, Analytische / QC-Dienstleistungen, Studien zur Vorformulierung, F&E, Formulierung / Galenische Gestaltung, QbD (Qualität durch Design), Prozessentwicklung, Prozessoptimierung, Prozess-Validierung, Entwurf von Stabilitätsstudien, Durchführung von Stabilitätsstudien, ICH-Stabilitätsstudien, Studien zur Vergleichbarkeit, Technologietransfer, Pilotanlage, Mischen der Formulierung, Forschungschargen, Technische Lose, Scale-up, Pilotchargen, Registrierung von Losen, Chargenprotokolle, Entwicklung von Analysemethoden, Validierung von Analysemethoden, Freigabeprüfung von Rohstoffen, Freigabeprüfung des Produkts, Übertragung von Analysemethoden
Adresse
42-44 rue de Longvic | 21300 Chenove France
Jahr
1985
 France
France
Kontakt
Wenn Sie Fragen oder Anregungen haben, klicken Sie hier. Wir helfen Ihnen gerne weiter.
Möchten Sie alle Informationen sehen?
Entfalten Sie die volle Kraft von MAI CDMO





