HIPRA BIOTECH SERVICES | Amer
Interne End-to-End-Fähigkeiten von der Zelllinienentwicklung bis zur kommerziellen Herstellung











Über die Anlage
HIPRA Biotech Services ist die CDMO-Abteilung von HIPRA, die Pharma- und Biotechnologieunternehmen seit über 50 Jahren wissenschaftliche und technische Spitzenleistungen anbietet. Wir bieten umfassende Auftragsentwicklungs- und -herstellungsdienste für eine breite Palette von Biologika-Technologien und -Modalitäten.
- Wir verfügen über freie Kapazitäten, um Entwicklungs-, klinische Liefer- und kommerzielle Herstellungsprojekte in den Bereichen Säugetiere, Mikroorganismen und aseptische Abfüllung und Fertigstellung zu starten.
- Wir sind in der Lage, 12 Monate vom Gen/Stamm bis zum Wirkstoff einzuhalten , wie BIMERVAX® (das wir jedes Jahr in 4-6 Monaten anpassen) und unsere typischen Vorlaufzeiten bei Dutzenden von Programmen in der Tiergesundheit zeigen.
- Wir haben seit fast 30 Jahren eine EMA-Zulassung mit einer ausgezeichneten Erfolgsbilanz bei Inspektionen, und wir bereiten uns auf die FDA-Zulassung bis Mitte 2026 vor.
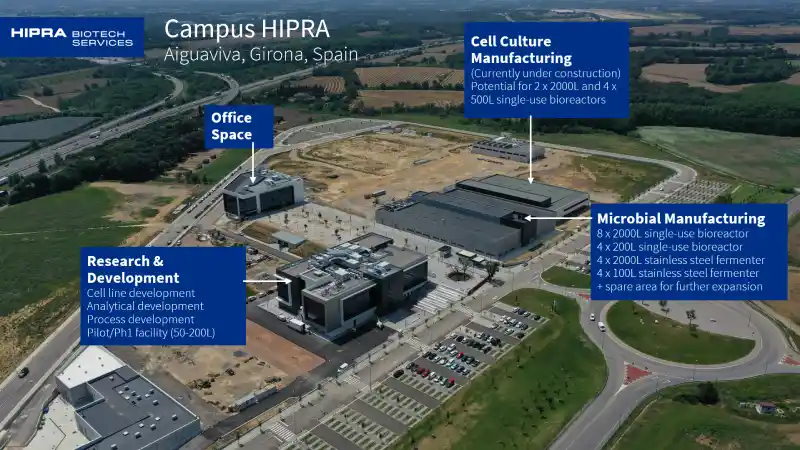
Unser AIGUAVIVA-Campus beherbergt unsere F&E-Labore und unsere Microbial DS-Produktionserweiterung.
Unser AMER-Campus bietet unsere mikrobiellen DS-, Säugetier-DS-, aseptischen F&F- und QC-Dienstleistungen.
ENTWICKLUNG (AIGUAVIVA-Campus)
Von der frühen Entdeckung bis zur klinischen Produktion beschleunigen wir jede Phase der Entwicklung von biologischen Arzneimitteln mit Fachwissen und Flexibilität.
Unsere AIGUAVIVA-Entwicklungslabors verfügen über Hochdurchsatz-Bioreaktorsysteme (Ambr®15 und Ambr®250) für die Versuchsplanung, Benchtop-Bioreaktoren im kleinen und mittleren Maßstab, Cobas®-Analysegeräte (für klinisch-chemische und immunchemische Assays) und fortschrittliche Tools für die Zelllinienentwicklung, ergänzt durch einen Spezialbereich für die Prozessentwicklung und einen speziellen GMP-Bereich für die klinische Chargenproduktion in der Frühphase.
HERSTELLUNG (Campus AMER und AIGUAVIVA)
In unseren hochmodernen, GMP-zertifizierten Anlagen bieten wir robuste und flexible pharmazeutische Produktions- und Qualitätskontrolldienste an.
Unsere AMER DS-Anlagen verfügen über hochmoderne 500-Liter-Einweg-Bioreaktoren für die Zellkultur, 2000-Liter-Einweg-Bioreaktoren für die mikrobielle Fermentation und Fermenter aus Edelstahl, Einweg-Chromatographie, Tangentialflussfiltration und Zentrifugen.
Unsere AIGUAVIVA DS-Erweiterungsanlage verfügt über 2000-Liter-Einweg-Bioreaktoren für die mikrobielle Fermentation und Fermenter aus Edelstahl, Einweg-Chromatographie, Tangentialflussfiltration und Zentrifugen.
Unsere AMER DP-Anlage verfügt über eine Hochgeschwindigkeitsabfüllanlage für Isolator-Flüssigfläschchen mit 100% IPC.
Unsere AMER QC-Labors verfügen über eine Vielzahl von Geräten, die eine breite Palette von Methoden ermöglichen; die Geräte sind dieselben, die auch im Labor für die Entwicklung analytischer Methoden verwendet werden.
Compliance
- ISO
- EMA (EU-GMP)
- FDA (cGMP)
- Gesundheit Kanada (Kanada GMP)
- Weltgesundheitsorganisation (GMP / HACCP)
- ANVISA (Brasilien B-GMP)
- ANMAT (Argentinien neue GMP)
- PMDA/MHLW (Japan GMP)
- ISP (Chile BPM)
- INVIMA
- MSPAS
- COFEPRIS
- DIGEMID
- MHRA (UK GMP)
- 9001
- 14001
Tätigkeit
- Abs (Antikörper), Peptide, Proteine, Hormone und Enzyme, Impfstoffe, Injektionsmittel, Fill&Finish, Fläschchen mit kleinem Volumen, FDF/DROGENPRODUKTE, BIOLOGIEN Herstellung
Eigenschaften
- Verwendet: Untersuchung, Kommerziell (Phase IV), Präklinisch, Phase I, Phase II, Phase III, Menschlich
- Toxizität (OEB-Einstufung): 1 / gering gefährdet (PDE > 5.000 µg/Tag), 2 (PDE = 1.000 - 5.000 µg/Tag), 3 (PDE = 100 - 1.000 µg/Tag)
- Kontrollierte Substanz: N/A
- BSL: 1, 2
- Therapeutische Bereiche: N/A
- Märkte: DIGEMID (Peru), COFEPRIS (Mexiko), INVIMA (Kolumbien), MSPAS (Guatemala), ISP (Chile), FDA (USA), EMA (EU), PMDA (Japan), Gesundheit Kanada (Kanada), MHRA (UK), ANVISA (Brasilien), ANMAT (Argentinien)
Chargengröße / Reaktor
- Klein, Mittel, Groß, Stapel, Fed-Batch, 1 - 100 L, 100 - 1000 L, 1000 - 2000 L
Dienstleistungen
- Entwicklungsdienste, Fertigungsdienstleistungen, Analytische / QC-Dienstleistungen, Dienstleistungen zur Qualitätssicherung, Verpackung, Logistik, Studien zur Vorformulierung, F&E, Formulierung / Galenische Gestaltung, QbD (Qualität durch Design), Prozessentwicklung, Prozessoptimierung, Prozess-Validierung, Entwurf von Stabilitätsstudien, Durchführung von Stabilitätsstudien, ICH-Stabilitätsstudien, Studien zur Vergleichbarkeit, Downstream, Fill&Finish, Entwicklung von Zelllinien, Zellbanking, Herstellung steriler Produkte, Herstellung nicht steriler Produkte, Upstream, Technologietransfer, Pilotanlage, Mischen der Formulierung, Forschungschargen, Technische Lose, Scale-up, Pilotchargen, Registrierung von Losen, Chargenprotokolle, Entwicklung von Analysemethoden, Validierung von Analysemethoden, Freigabeprüfung von Rohstoffen, Freigabeprüfung des Produkts, Bioanalytik, Übertragung von Analysemethoden, QP im Haus, Chargenzertifizierung / Freigabe, GMP-Dokumentation, Primärverpackung, Sekundärverpackung, Kennzeichnung, Serialisierung, Lagerung, Vertrieb, BIP
Adresse
Avinguda de la Selva, 135, 17170 Amer, Girona
Jahr
1971
 Spain
Spain
Dokumente
Andere Anlagen dieses Unternehmens
Kontakt
Wenn Sie Fragen oder Anregungen haben, klicken Sie hier. Wir helfen Ihnen gerne weiter.
Möchten Sie alle Informationen sehen?
Entfalten Sie die volle Kraft von MAI CDMO







 HIPRA BIOTECH SERVICES | Aiguaviva
HIPRA BIOTECH SERVICES | Aiguaviva